研究紹介
癌細胞と正常上皮細胞との相互作用
1980年頃に最初の癌遺伝子Srcが発見されて以来、数多くの癌遺伝子あるいは癌抑制遺伝子が同定されてきました。そして、それらの変異がどのように細胞のシグナル伝達や性状に影響を与えるかについて明らかにされてきました。現在の癌治療の潮流は、それらの知識をもとに癌細胞と正常細胞の差異をターゲットにして癌細胞を特異的にたたくというものです。しかし、それらの研究において、癌は正常な細胞から起こり、正常な細胞に囲まれながら増えていくという事実はあまり顧みられることはありませんでした。癌細胞と周りの正常細胞はお互いの存在を認識できるのでしょうか?また、両者は何か作用を及ぼし合うのでしょうか?
私たちの研究室では、新たに確立した培養細胞系を用いて、正常上皮細胞と様々なタイプの変異細胞との境界で起こる現象を解析しています。非常に面白いことに、癌遺伝子SrcやRas変異細胞が正常細胞に囲まれると、変異細胞内の様々なシグナル伝達が活性化され、その結果、変異細胞が正常上皮細胞層からはじき出されるように管腔側(体の外側)へと排出されることが観察されました(Hogan et al., 2009, Nature Cell Biology; Kajita et al., 2010, Journal of Cell Science)。またある種の癌抑制遺伝子変異細胞は正常細胞に囲まれるとアポトーシスを起こし正常上皮細胞層から失われていくことも明らかとなりました(未発表データ)。これらの現象は変異細胞のみを培養した時には見られないことから、周囲の正常細胞の存在が、変異細胞のシグナル伝達や性状に大きな影響を与えうることを示しています。これらの研究は非常に新奇なものであり、現在多くの研究者たちの注目を集めつつあります(Nature, Research Highlight, 2010,vol 463 など)。
次の大きなクエスチョンは、どのような分子メカニズムで正常細胞と癌細胞がお互いを認識しそれぞれのシグナル伝達を制御するのかです。今後はそれらに関わる重要な分子の特定に全力で立ち向かっていきたいと考えています。正常細胞と癌細胞の境界で特異的に機能している分子が特定されれば、それらはドラッグターゲットあるいは診断のマーカーとなります。正常細胞が癌細胞を排除するメカニズムを活性化する、あるいは癌細胞が正常細胞からの排除を免れるメカニズムを不活性化する、すなわち、『周辺の正常細胞に癌細胞を攻撃させる』という、従来の癌治療の観点とは全く異なった新奇の癌治療へとつなげていきたいと考えています。また、正常細胞と癌細胞間の境界分子の同定は、これまで技術的に検出の難しかった形態変化を伴わない初期癌(field cancerization)の新たな検出方法の開発につながっていくものと期待されます。
以下に、我々の研究成果の一つを紹介させていただきます。
Characterization of the interface between normal and Ras-transformed epithelial cells
(Hogan et al., 2009, Nature Cell Biology)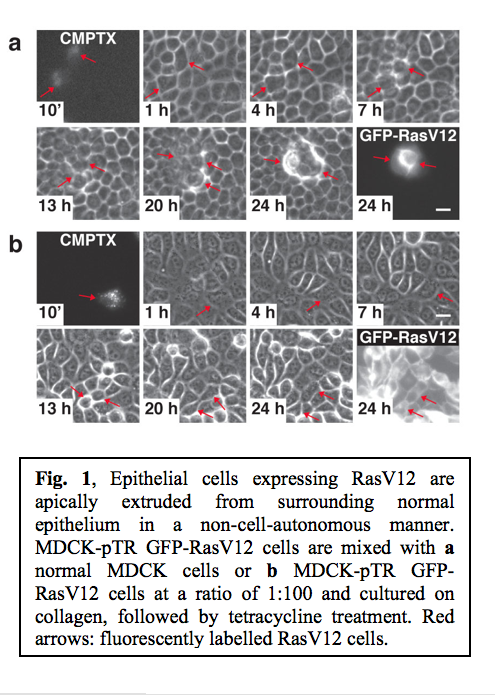 Rasは最も研究の進んでいる癌遺伝子の一つであり、ヒトの癌の30%でその変異が認められている。正常上皮細胞とRas変異上皮細胞の境界でおこる現象を解析するため、最初に私たちはGFPタグをつけた活性化型(発癌性)Ras (RasV12)をテトラサイクリン依存性に発現するMDCK上皮細胞株 (MDCK-pTR GFP-RasV12)を確立した。まず、MDCK-pTR GFP-RasV12細胞を蛍光性色素(CMTPX)でマークした後、非変異性のMDCK細胞と1:100の割合で混ぜ、コラーゲンゲル上で共培養した。細胞が一層の上皮細胞層を形成した後、テトラサイクリンを添加し、正常細胞に囲まれたRas変異細胞がどのような挙動を示すのか観察した。すると、テトラサイクリン添加13~25時間後にRas変異細胞が上皮細胞層のapical 側(管腔側)に弾き出されるように逸脱するのが観察された。Ras変異細胞は逸脱した後も増殖を続け大きな細胞塊を形成した(Fig. 1a)。重要なことに、蛍光色素で染めたRas変異細胞を染めていないRas変異細胞と共培養しても細胞層からの逸脱は観察されなかった(Fig. 1b)。このことは、Ras変異細胞の上皮細胞層からの逸脱には、周りの正常細胞の存在が必要であることを示唆している。
Rasは最も研究の進んでいる癌遺伝子の一つであり、ヒトの癌の30%でその変異が認められている。正常上皮細胞とRas変異上皮細胞の境界でおこる現象を解析するため、最初に私たちはGFPタグをつけた活性化型(発癌性)Ras (RasV12)をテトラサイクリン依存性に発現するMDCK上皮細胞株 (MDCK-pTR GFP-RasV12)を確立した。まず、MDCK-pTR GFP-RasV12細胞を蛍光性色素(CMTPX)でマークした後、非変異性のMDCK細胞と1:100の割合で混ぜ、コラーゲンゲル上で共培養した。細胞が一層の上皮細胞層を形成した後、テトラサイクリンを添加し、正常細胞に囲まれたRas変異細胞がどのような挙動を示すのか観察した。すると、テトラサイクリン添加13~25時間後にRas変異細胞が上皮細胞層のapical 側(管腔側)に弾き出されるように逸脱するのが観察された。Ras変異細胞は逸脱した後も増殖を続け大きな細胞塊を形成した(Fig. 1a)。重要なことに、蛍光色素で染めたRas変異細胞を染めていないRas変異細胞と共培養しても細胞層からの逸脱は観察されなかった(Fig. 1b)。このことは、Ras変異細胞の上皮細胞層からの逸脱には、周りの正常細胞の存在が必要であることを示唆している。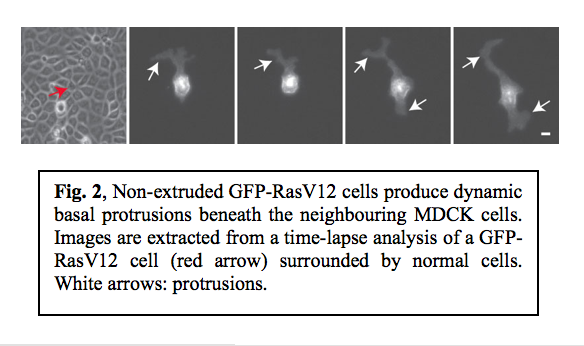 正常細胞に囲まれた80%以上ののRas変異細胞は上皮細胞層のapical 側に逸脱したが、その他のRas変異細胞は逸脱しなかった。私たちはapical 側に逸脱しなかったRas変異細胞が周囲の正常細胞のbasal 側(基底側)に大きな突起(時に4~5細胞長に及ぶ)を伸展・退縮させていることを見いだした(Fig. 2)。Ras変異細胞のみを培養したときにはそのような大きな突起の形成は見られなかった。このことは、basal 側の突起の形成にはRas変異のみでなく周囲の正常細胞の存在が必要であることを示している。このように、正常上皮細胞層で1つの細胞にRas変異が起こると2つの異なる現象が非細胞自律性(non-cell-autonomous)に生じる(Fig. 3)
正常細胞に囲まれた80%以上ののRas変異細胞は上皮細胞層のapical 側に逸脱したが、その他のRas変異細胞は逸脱しなかった。私たちはapical 側に逸脱しなかったRas変異細胞が周囲の正常細胞のbasal 側(基底側)に大きな突起(時に4~5細胞長に及ぶ)を伸展・退縮させていることを見いだした(Fig. 2)。Ras変異細胞のみを培養したときにはそのような大きな突起の形成は見られなかった。このことは、basal 側の突起の形成にはRas変異のみでなく周囲の正常細胞の存在が必要であることを示している。このように、正常上皮細胞層で1つの細胞にRas変異が起こると2つの異なる現象が非細胞自律性(non-cell-autonomous)に生じる(Fig. 3)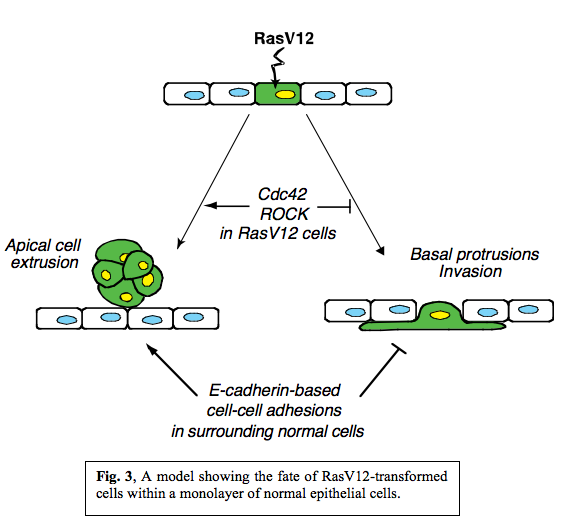 :Ras変異細胞はapical 側に逸脱するか、basal 側に突起をのばして基底側マトリックスに浸潤していく。私たちはさらに、正常細胞に囲まれたRas変異細胞内でCdc42やミオシン-IIなど様々なシグナル伝達経路が活性化することも見いだした。Ras変異細胞内のCdc42あるいはROCK活性、および周囲の正常細胞のE-カドヘリンを介する細胞間接着の状態が、Ras変異細胞がapical 側に逸脱するかあるいはbasal 側に突起をのばすかの選択に大きな影響を与える。このように、Ras変異細胞とそれを取り巻く正常細胞内のシグナルのトータルのバランスが正常上皮細胞層内でのRas変異細胞の挙動を決定することが明らかになった。
:Ras変異細胞はapical 側に逸脱するか、basal 側に突起をのばして基底側マトリックスに浸潤していく。私たちはさらに、正常細胞に囲まれたRas変異細胞内でCdc42やミオシン-IIなど様々なシグナル伝達経路が活性化することも見いだした。Ras変異細胞内のCdc42あるいはROCK活性、および周囲の正常細胞のE-カドヘリンを介する細胞間接着の状態が、Ras変異細胞がapical 側に逸脱するかあるいはbasal 側に突起をのばすかの選択に大きな影響を与える。このように、Ras変異細胞とそれを取り巻く正常細胞内のシグナルのトータルのバランスが正常上皮細胞層内でのRas変異細胞の挙動を決定することが明らかになった。
この研究で最も大切な点は、周囲の正常細胞の存在が、Ras変異細胞の細胞内シグナル伝達とその挙動に大きな影響を与えることである。
今後の研究課題
1)正常上皮細胞と様々なタイプの変異細胞との境界でおこる多様な現象の詳細な解析
これまでの私たちの研究で、正常上皮細胞に囲まれた変異細胞が、apical 側に逸脱する、あるいはアポトーシスによって上皮細胞層から除去されることが明らかとなった。今後,これらの過程でどのようなシグナル伝達系が関与しているかその詳細を明らかにしていきたい。
2)正常上皮細胞と変異細胞の細胞間認識メカニズムの解明
最も魅惑的かつ難しいクエスチョンは、『どのようにして正常細胞と変異細胞がお互いの違いを認識しているのか』である。現在私たちは、生化学的な手法を主に用いて、細胞間認識メカニズムに関与している分子のスクリーニングを精力的に行っている。
3)In vivo システムの確立
もう一つの大切なクエスチョンは、私たちが培養細胞で見いだした現象が実際に生体内でも起こっているのか、である。私たちは現在、ショウジョウバエ,ゼブラフィッシュ,マウスを用いて正常上皮細胞と変異細胞間でどのような現象が生じるのか解析を始めている。